物質量へ 周期表 「高校生の部屋」に戻る
化学式【単体】
| 物質名 |
化学式 |
物質名 |
化学式 |
物質名 |
化学式 |
| 水素 |
|
マグネシウム |
|
鉄 |
|
| ヘリウム |
|
アルミニウム |
|
銅 |
|
| 炭素 |
|
硫黄 |
|
亜鉛 |
|
| 窒素 |
|
塩素 |
|
銀 |
|
| 酸素 |
|
カリウム |
|
バリウム |
|
| ナトリウム |
|
カルシウム |
|
水銀 |
|
水素:H2 ヘリウム:He 炭素:C 窒素:N2 酸素:O2 ナトリウム:Na
マグネシウム:Mg アルミニウム:Al 硫黄:S 塩素:Cl2 カリウム:K カルシウム:Ca
鉄:Fe 銅:Cu 亜鉛:Zn 銀:Ag 水銀:Hg
【化合物】
| 物質名 |
化学式 |
物質名 |
化学式 |
物質名 |
化学式 |
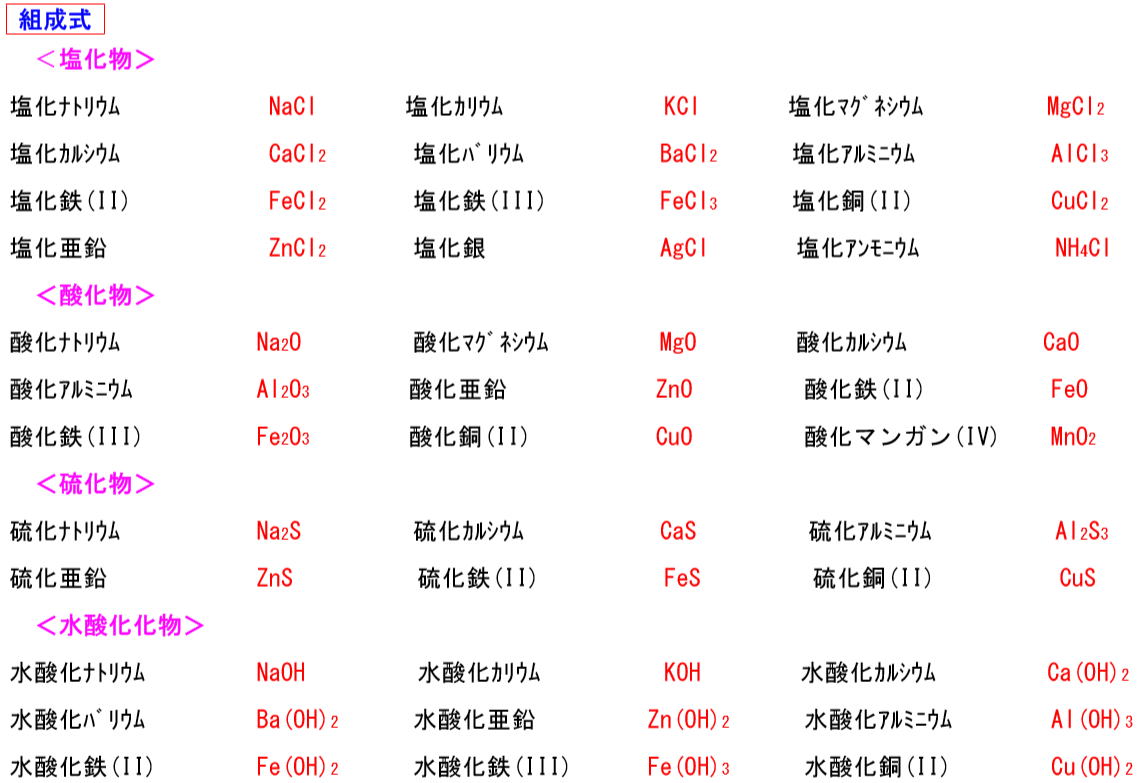
| 水 |
H2O |
酸化銅 |
CuO |
塩化ナトリウム |
NaCl |
| アンモニア |
NH3 |
酸化マグネシウム |
MgO |
塩化水素 (塩酸) |
HCl |
| 二酸化炭素 |
CO2 |
酸化銀 |
Ag2O |
塩化銅 |
CuCl2 |
| 炭酸水素ナトリウム |
NaHCO3 |
水酸化ナトリウム |
NaOH |
硫酸 |
H2SO4 |
| 炭酸ナトリウム |
Na2CO3 |
水酸化カリウム |
|
硫化鉄 |
FeS
|
|
|
水酸化カルシウム |
|
硫化水素 |
H2S |
|
|
水酸化バリウム |
|
|
|
|
1.化学反応式
難しく考えないことです。ただし覚えるべきことはしっかり覚えましょう。
どうしても思い出せない人は「簡単な反応式」に戻って考えましょう。
化学反応式のつくり方
1⃣ 反応物(反応する物質)の化学式を左辺、生成物の化学式を右辺に書き、→で両辺を結ぶ。
2⃣ 同じ元素の原子の数が両辺で等しくなるよう係数を決める。係数が1になるときは省略する。 |
例)炭酸水素ナトリウム NaHCO3は、希硫酸 H2SO4と反応して二酸化炭素 CO2を発生する。
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
反応物: NaHCO3 と H2SO4
生成物: Na2SO4 と CO2 と H2O
H2SO4 Na2SO4の係数1は省略しています。
左辺のナトリウム Naの数は2 右辺のナトリウムの数も2
左辺の炭素Cの数は2 右辺の炭素の数も2
左辺のSO4の数は1 右辺のSO4の数も1
左辺の水素原子Hの数は2+2=4 右辺の水素原子の数も2×2=4
左辺の酸素原子Oの数は(3×2)+4=10
右辺の酸素原子の数4+(2×2) + 2=10
反応式の両辺で各原子の数は等しい。
それでは、エタノール C₂H₆O を完全燃焼させたときの化学反応式を考えてみましょう。
1. (まず)、反応物と生成物を考えます。完全燃焼させるので、酸素O₂と反応することがわかります。
次に、燃焼後の生成物は何ができるのか、考えましょう。
炭素 C と水素 H を含む化合物を燃焼させるので、生成物の二酸化炭素 CO₂ と水 H₂O ができます。
C₂H₆O + O₂ → CO₂ + H₂O
2. (次に)左辺、右辺の原子の数が合うように係数を決めます
エタノールの係数を 1 (省略)とします。
すると、左辺の炭素原子 C が 2 個、水素原子 H が 6 個。右辺で炭素原子があるのは二酸化炭素、
そこで二酸化炭素の係数は 2 と決まります。
また右辺で水素原子があるのは水だけなので、水の係数は 3 ですね。
C₂H₆O + O₂ → 2CO₂ + 3H₂O
最後に左辺の酸素 O₂ の係数を決めます。
左辺には酸素原子が 1 個。右辺には酸素原子が 7 個あります。
左辺で酸素原子が 6 個足りないので、O₂ の係数は 3 に決まります。
C₂H₆O + 3 O₂ → 2 CO₂ + 3 H₂O
(係数 1は省略)
|
問1 次の各化学反応式に係数を入れよ。
(1) Mg + O₂ → MgO
(2) KI + CL₂ → KCI + I₂
(3) H₂S +SO₂ → H₂O + S
(4) C₂H₂ + O₂ → CO₂ + H₂O
|
(1) 2Mg + O2 → 2MgO ※ マグネシウムの燃焼
(2) 2KI + Cl2 → 2KCI + I2
※カリウムとヨウ素からなる無機化合物ヨウ化カリウムと塩素の化合
(3) 2H2S +SO2 → 2H2O + 3S
(4) 2C2H2 + 5O2 → 4CO2 + 2H2O ※アセチレンの燃焼
例1) 次の化学反応式の係数を求めてみよう。
( )N2 + ( )H2 → ( )NH3
左辺と右辺の原子の数を同じにする。
数合わせゲームと同じで、気楽にやりましょう。
まず、NH3に注目すると、左辺の水素原子は2つ。右辺は3個。
とりあえず右辺の係数を2(分子の数=2)にしてみよう。
( )N2 + ( )H2 → 2NH3
左辺の水素原子は6個。
今度は左辺のH2の係数を3にすると、左辺の水素原子も6個となった。
( )N2 + 3H2 → 2NH3
窒素原子はそのままで、左辺と右辺の数が合うので、1になり、1は省略します。
1N2 + 3H2 → 2NH3 N2 + 3H2 → 2NH3
|
例2)エタンC2H6(天然ガスの成分)燃焼の化学反応式の係数は?
エタンC2H6燃焼はO2と反応し、二酸化炭素CO2とH2Oを生じます。□は係数。
□C2H6 + □O2 → □CO2 + □H2O
次に□内の係数について考えましょう。
①まず炭素原子「C」に着目。左辺は2つ、右辺は1個なので
C2H6 + □O2 → 2CO2 + □H2O
② 水素原子に着目し、水分子に係数をつける。
C2H6 + □O2 → 2CO2 + 3H2O
③ 酸素原子に着目し、酸素分子に係数をつける。
C2H6 + 7/2O2 → 2CO2 + 3H2O
④ 最も簡単な整数の比になるよう、全体を2倍します。
2C2H6 + 7O2 → 4CO2 + 6H2O
|
例3)アセチレンの燃焼は? C2H2 + O2 → CO2+ H2O
アセチレンは炭素原子が2つなので二酸化炭素の係数を2に、
水素原子は2なので水の係数は1にします。
C2H2 + O2 → 2CO2+ H2O
そうすると右辺の酸素原子「O」の数が5となり、左辺の酸素原子は2個。
そこで左辺の酸素の係数を2分の5とします。
C2H2 + 5/2O2 → 2CO2+ H2O
分数になってしまうので、最後に全て2倍して
2C2H2 + 5O2 → 4CO2+ 2H2O
|
問1 次の各化学反応式に係数を入れよ。省略する箇所には×を書きなさい。
(1) ( )Cu + ( )O2 → ( )CuO
(2) ( )H2O2 → ( )H2O + ( )O2
(3) ( )C2H2 +( )O2 → ( )CO2 + ( )H2O
(4) ( )CuO + ( )C → ( )Cu + ( )CO2
(5) ( )CaCO3 + ( )HCl
→ ( )CaCl2 + ( )CO2 + ( )H2O
|
答)(1) 2,×,2 (2) 2,2,× (3)
(4) 2,×,2,× (5) ×,2,×,×,×
問2 化学反応式で表しなさい。
(1) マグネシウムに塩酸を加えると、水素と塩化マグネシウムMgCl2が生じる。
(2) メタノールCH3OHが燃焼すると,二酸化炭素と水が生じる。 |
(1) Mg + 2HCl → MgCl2 + H2
(2) 2CH3OH + 3O2 → 2CO2 + 4H2O
有機物が完全燃焼したときの化学反応式は 有機物 + 酸素→水 + 二酸化炭素
Cx2 Hx8 Ox8 Cx2 Hx8 Ox8
-------------------------------------------------------------------------------------
【参考】複雑な化学反応式の作り方(未定係数法)を以下に書きます。
「反応の前後で、原子の数は変わらない」ので
係数を未知数として両辺の原子の数に関する連立方程式を使って係数の値を求めます。
アンモニアと酸素が化合し、一酸化窒素NOと水H2Oが生じる場合で考えてみましょう。
NH3 + O2 →NO+H2Oお各物質の係数をa,b,c,dとすると、
aNH3 + bO2 → cNO + dH2O
……
窒素原子Nの係数から a=c …… ①
水素原子Hの係数から 3a=2d …… ②
酸素原子Oの係数から 2b=c+d …… ③
①~③の方程式を解くと、 ※比を求めるため、ここではaでまとめます。
c=a , 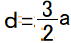 ,
, 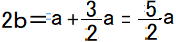 より
より 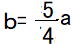
a : b : c : d = 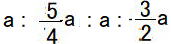 以下、 整数の比にするため4倍します。
以下、 整数の比にするため4倍します。
a : b : c : d =4:5:4:6 a=4 b=5 c=4 d=6 で、
4NH3 + 5O2 → 4NO + 6H2O となります。
----------------------------------------------------------
問)① ( )Al + ( )O2 → ( )Al2O3
②( )C2H5OH + ( )O2 → ( )CO2 +( )H2O
1molのエタノールが3molの酸素と反応して、
2molの二酸化炭素と3molの水(水蒸気)が生成される反応式です。
③ ( )N2 + ( )H2 → ( )NH3
④ ( )NaOH + ( )HCl → ( )NaCl + ( )H2O
⑤ ( )C3H8+ ( )O2 → ( )CO2 + ( )H2O
⑥( )Al + ( )H2SO4 → ( )Al2(SO4)3 + ( )H2
⑦ ( )C2H6+ ( )O2 → ( )CO2 + ( )H2O
⑧( )Zn + ( )HCl2 → ( )ZnCl2 + ( )H2
⑨ ( )C4H10 + ( )O2 → ( )CO2 +( )H2O
⑩ ( )CaCO3 + ( )HCl →
( )CaCl2 +( )H2O + ( )CO2
|
⑤と⑦と⑨は無理しないでください。
答)① 4,3,2 ② 1,3,2,3 ③ 1,3,2 ④ 1,1,1,1 ⑤ 1,7,3,4
⑥ 2,3,1,3 ⑦ 2,7,4,6 ⑧ 2,2,2,1 ⑨ 2,13,8,10 ⑩ 1,2,1,1,1
2.イオン反応式
イオン反応式…イオンが関係する反応を式で表すとき、反応しないイオンは示さず、
反応したイオンだけをイオン式で示した化学反応式
例1)硝酸銀水溶液 AgNO3 は希塩酸(塩化水素)HClと反応して
塩化銀AgClの沈殿を生じます。
①まず化学反応式を書こう。
AgNO3 + HCl → AgCl + HNO3
② Ag+ + NO3ー + H+ + Cl- → Ag+ + Cl- + HNO3
・反応しないので省略する陽イオン … H+ …塩化水素が電離してできた陽イオン
・反応しないので省略する陰イオン … NO3- …硝酸銀が電離してできた陰イオン
③ 反応しないイオンを省略する。
Ag+ + NO3ー + H+ + Cl- → AgCl + HNO3
イオン反応式は Ag+ + Cl- → AgCl ↓ (↓:沈殿) |
※ 必要があれば両辺の各元素の原子の数や両辺のもつ電荷の総和が
等しくなるように係数をつける。
例) [ ]Ca(OH)2 → [ ]Ca2+ + [ ]OHー
Ca(OH)2 → Ca2+ + 2OHー
問 次の各イオン反応式に係数を入れよ。省略するところには×を書け。
(1) [ ]HNO3→ [ ]H+ + [ ]NO3
(2) [ ]NH3 + [ ]H2O → [ ]NH4+ + [ ]OH-
(3) [ ]Al3+ + [ ]OH- → [ ]Al(OH)3
(4) [ ]Al + [ ]Cu2+ → [ ]Al3+ + [ ]Cu |
答 (1) [×]HNO3→ [×]H+ + [×]NO3ー
(2) [×]NH3 + [×]H2O → [×]NH4+ + [×]OHー OK
(3) [×]Al3+ + [3]OH- → [×]Al(OH)3 OK
(4) [×]Al + [×]Cu2+ → [×]Al3+ + [×]Cu
(2) NH₃はNaOHのように水に溶けたときに分裂してOH⁻がでるのではなく、
H₂OからH⁺を奪うことによって結果としてOH⁻が出てきます。
それで、出てきたOH⁻が酸と反応します。
例2)イオン反応式のつくりかた
硝酸銀 AgNO3 水溶液に銅の針金を漬けておくと、
銅は銅イオンはCu2+となって解け、表面に銀が析出する。
この化学変化をイオン反応式で表してみよう。
硝酸銀の電離 AgNO3 → Ag+ + NO3ー
銅との化学変化をイオン反応式で表す。
Ag+ + NO3- + Cu → Ag + NO3- + Cu2+
この式から、反応を通じて変化しないNO3ーを消去すると、
Ag+ + Cu → Ag + Cu2+ (Cu → Cu2+2e)
両辺の各元素の原子の数や両辺のもつ電荷の総和が等しくなるように係数をつける
2Ag+ + Cu → 2Ag + Cu2+ |
例3)イオン反応式のつくりかた
① 化学反応式を書く。
Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
② イオン式を書く。
Ba2+ +2NO3ー + 2Na+ + SO42ー →
BaSO4 + 2Na+ +2NO3ー
③ 反応を通じて変化しないイオンを消去する
Ba2+ +2NO3ー + 2Na+ + SO4ー →
BaSO4 + 2Na+ +2NO3ー
Ba2+ + SO4ー → BaSO4
|
3.化学変化の量的関係
① 化学変化に関係する物質の分子の数の比は反応式の係数の比と等しい。
② 化学変化に関係する物質の物質量の比は、反応式の係数の比と等しい。
③ 化学変化に関係する物質の質量の比は、モル質量と係数から求められる。
④ 化学変化に関係する気体の体積の比は、モル質量と係数から求められる。
中学で学習した水の電気分解を思い出しましょう。
例題 電気分解により水素と酸素が発生しますね。化学反応式で表すと、
① [ ]H2O → [ ]H2 + [ ]O2
水分子[ ]個が分解して、水素分子[ ]個と酸素分子[ ]個ができますね。
分子の数の比は反応式の係数の比と等しいので、
・水分子の数 : 水素分子の数 = 1:[ ]
・水分子の数 : 酸素分子の数 = [ ]:1
上の式から、仮に水分子10個が分解された際できる水素分子と酸素分子の数は?
・水素分子の数 = [ ]個 ・酸素分子の数 = [ ]個
それでは
② 水分子を分解したところ酸素分子30個が生じた。
このとき①で分解された水分子は何個か。また、生じた水素分子は何個か?
・水分子[ ]個 酸素分子[ ]個
|
答)① 2H2O → 2H2 + O2 左の化学反応式から
水分子2個が分解して、水素分子2個と酸素分子1個ができますね。(係数1は省略)
分子の数の比は反応式の係数の比と等しいので、
・水分子の数 : 水素分子の数 = 1:[ 1 ]
・水分子の数 : 酸素分子の数 = [ 2 ]:1
上の式から、仮に水分子10個が分解された際できる水素分子と酸素分子の数は,
・水素分子の数 = [10]個 ・酸素分子の数 = [5] (水や水素分子の半分)
② 水分子を分解したところ酸素分子30個が生じたので、
このとき①で分解された水分子と水素分子の数は、
・水分子[60]個 水素分子[60]個 となります。
分子の数の比は反応式の係数の比と等しいことから分かりますね。
問 水素( )を燃焼させると水( )ができる。
①( )に分子式を書け。
② 水素の燃焼を表す化学反応式を書け。
③ 水素分子50個を完全燃焼させた。このとき必要な酸素分子と、
このときにできた水分子の数はそれぞれ何個か?
必要な酸素分子の数 = [ ]個 できた水分子の数= [ ]個
④ 水素分子100個と酸素分子100個の混合気体に点火した。完全燃焼ではないね
このときに起こった反応を説明した次の文の( )内に語句や数字を書け。
反応しない[ ]分子が[ ]個残り、[ ]個の水分子ができた。
|
答) ①素(H2)を燃焼させると水(H2O)ができる。
② 水素の燃焼を表す化学反応式を書け。 2H2 + O2 → 2H2O
③ 水素分子50個を完全燃焼させた。このとき必要な酸素分子と、
このときにできた水分子の数はそれぞれ何個か?
必要な酸素分子の数 = [ 25 ]個 できた水分子の数= [ 50 ]個
④ 水素分子100個と酸素分子100個の混合気体に点火した。
このときに起こった反応を説明した次の文の( )内に語句や数字を書け。
酸素分子が100個とすると、水素分子200個が必要です。この場合完全燃焼でなく、
酸素分子が100個に合わせます。水素分子100個, 酸素分子は50個となり、
反応しない[ 酸素 ]分子が[ 50 ]個残り、[ 100 ]個の水分子ができた
以下に、化学変化の量的関係を以下に示します。
例1 プロパンC2H2の燃焼
化学反応式 C2H8 + 5O2 → 3CO2 + 4H2O
反応物と生成物 プロパン 酸素 二酸化炭素 水
分子の数の関係 1分子 5分子 3分子 4分子 分子の数の比
物質量の関係 1[mol] 5[mol] 3[mol] 4[mol] 物質量の比
質量の関係 44g 32×5g 44×3g 18×4g
気体体積の関係 22.4L 22.4×5L 22.4×3L ー 体積の比
|
① 化学変化に関係する物質の分子の数の比は反応式の係数の比と等しい。
② 化学変化に関係する物質の物質量の比は、反応式の係数の比と等しい。
③ 化学変化に関係する物質の質量の比は、モル質量と係数から求められる。
④ 化学変化に関係する気体の体積の比は、モル質量と係数から求められる。
例2 メタンCH4の燃焼
化学反応式 CH4 + 2O2 → CO2 + 2H2O
反応物と生成物 メタン 酸素 二酸化炭素 水
分子数の比 1分子 2分子 1分子 2分子
物質量の比 1[mol] 2[mol] 1[mol] 2[mol]
質量 16g (32×2)g 44g (18×2)g
質量の比 4 : 16 : 11 : 9
16+ (32×2)=80g 44+ (18×2)=80g
化学変化の前後で物質の質量総和は変わらない…質量保存の法則
体積 22.4L (22.4×2)L 22.4L 液体 36.0mL(密度1.0g/mL)
体積の比 1 : 2 : 1 : 2(水蒸気)
気体の反応では、各気体の体積は同温同圧の下で簡単な整数比になる…気体反応の法則
|
問 エタノールC2H5OH の燃焼を表す化学反応式は
C2H5OH +3O2 → 2CO2 + 3H2O になる。
(1) エタノール46gを燃焼させた。次の物質の質量は?
①燃焼に必要な酸素 ②燃焼してできた二酸化炭素 ③燃焼でできた水
(2) 化学変化の前後で各物質の質量の総和は変わらない。
このことを( )の法則という。 |
答)



ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー