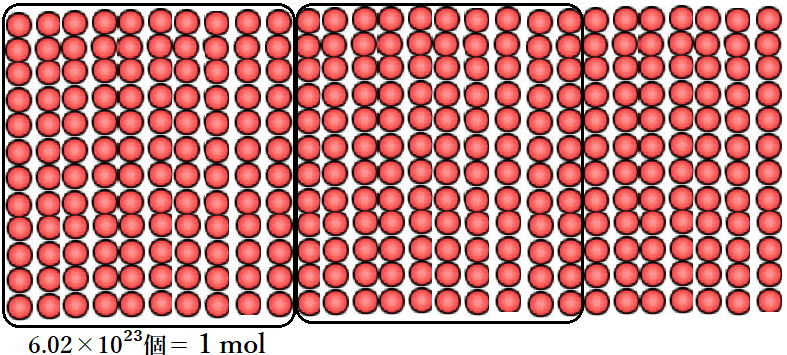
1個ずつ数えるのはたいへん。
そこで登場するのがmol (物質量)です。

化学 周期表 化学式 戻る
難しく考えないことです。数多く、問題を解くことで計算式に慣れましょう。
原子量・体積・アボガトロ数など
化学で扱う物質は原子という小さい粒が集まることでできています。
1個ずつ数えるのはたいへん。
そこで登場するのがmol (物質量)です。

 |
![]()

・アボガドロ定数

※アボガドロ氏:約200年前にイタリアの化学者
・物質量と質量の関係
これは炭素原子を6.02×10²³個集めると、
質量が原子量の数字と同じ12gになるようになっています。
炭素の¹²C
同様に原子量23のナトリウム(²³Na)を1mol集めると23g
原子量1の水素(¹H)は1g,
原子量16の酸素は(¹⁶O)は16gで
質量が原子量の数字と同じになるようになっています。
水(H₂O)分子はどうでしょうか?
水素原子2個と酸素原子1個からなりますので、2+16で18g。
つまり分子量18の水を1mol 集めると18gになります。
式量(イオン)58.5の塩化ナトリウムを1mol 集めると58.5gになります。
1mol 集めれば質量が原子量、分子量、式量、それぞれ一致します。
原子量、分子量、式量それぞれに1molで何グラムになるかを
「モル質量」といい、原子量、分子量、式量にg/molを付けた単位になります。
[memo]

[原子量と分子量]の違い
分子量とは、原子量を足したものになります。前に説明しましたが、
たとえば、H₂Oの分子量を考えてみましょう。
水素H(原子量:1)が2個と酸素O(原子量:16)が1個で構成されてますので、
H₂Oの分子量は1×2+16×1=18 になります。
分子量も原子量も同じく相対値なので単位はありません。
しかし原子量同様に、まれに[g/mol:モル質量]という単位が使われます。
・物質量と体積の関係
全ての理想気体1molは標準状態で、気体の種類に関係なく22.4Lになります。
1molで22.4Lを22.4L/molと表します。
| 物質量と質量、体積、個数の関係 左図のこの関係は分かりやすく、 非常に重要なので完全マスターしよう!! 下に図①~⑥まで解説、関連した問いといっしょに しっかり押さえておきましょう |
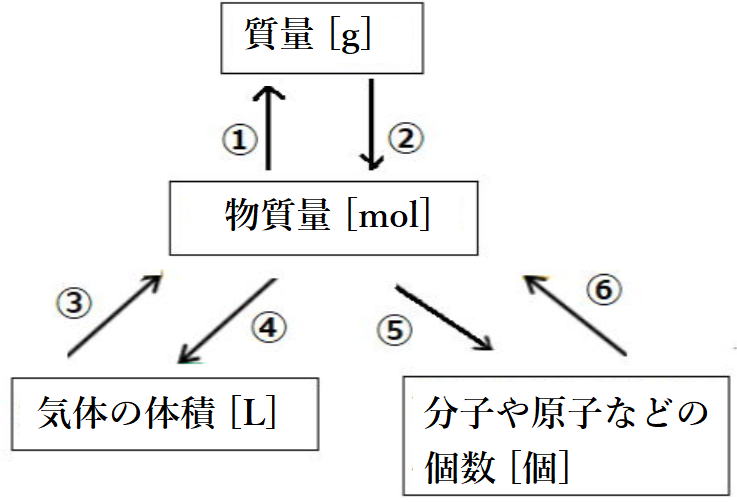 |
①物質量[mol]Xモル質量[g/mol]= 質量[g]
![]()
![]()
②質量[g] / モル質量[g/mol]= 物質量[mol]
![]()
![]()
③体積[L] / 22.4[L/mol] = 物質量[mol]
![]()
![]()
④物質量[mol]X22.4[L/mol] = 体積[L]
![]()
![]()
⑤物質量[mol]X(6.0X1023)[/mol]= 個数
![]()
![]()
⑥個数 / (6.0X1023 )[/mol] = 物質量[mol] ![]()
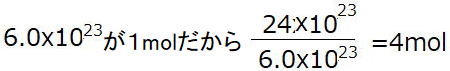
練習1) 原子量は以下の値を用いる。
H=1 C=12 N=14 O=16 Na=23 Al=27 S=32 Cl=35.5 Ca=40
物質量について①~⑩の問いに答えよ。
気体の体積は標準状態のときの値とします。
① エタンC2H6 0.25[mol]は何gか。
② 二酸化炭素CO2、 22gの物質量は何[mol]か。
③ O2 0.5[mol]の体積は何[L]か。
④ CO2 56.0[L]の物質量は何[mol]か。
⑤ 水素分子H2 1.5[mol]の粒子の個数は?
⑥ N2(窒素分子) 3.0x1023個の物質量は何[mol]か。
⑦ メタンCH4 11.2[L]の質量は何gか。
⑧ プロパンC3H8 22gの体積は何[L]か。
⑨ 炭素原子C 3.6x1023個の質量は何gか。
⑩ 28[L]の酸素O2中に含まれる酸素分子の数は何個か。
※ 物質量mol(モル)を基本に考えよう
| 解説 ① エタンC₂H₆ 0.25[mol]は何gか。 C₂H₆の1molの分子量=30 30×0.25=7.50g ② 二酸化炭素CO₂、22gの物質量は何[mol]か。 CO₂の1molの分子量=44 22/44=0.5mol ③ 酸素分子0.5[mol]の体積は何[L]か。 22.4×0.5= 11.2L ④ 二酸化炭素 56.0[L]の物質量は何[mol]か。 CO₂の1molの体積は22.4L 56.0÷22.4=2.5 2.5mol ⑤ 水素分子H₂ 1.5[mol]の粒子の個数は? 6.02×10²³ ×1.5=9.03×10²³ 9.03×10²³個 ⑥ 窒素分子 3.02×10²³個の物質量は何[mol]か。0.5mol ⑦ メタンCH₄ 11.2[L]の質量は何gか。 1molが22.4Lなので 0.5mol CH₄ の分子量=16 よって 16×0.5=8.0g ⑧ プロパンC₃H₈ 22gの体積は何[L]か。 C₃H₈の1molの質量は 44g 22g=0.5mol 22.4×0.5=11.2L ⑨ 炭素原子C 3.02×10²⁴個の質量は何gか。 1mol=6.02×10²³ 3.02×10²⁴÷6.02×10²³=5mol 12×5=60g ⑩ 28[L]の酸素O₂中に含まれる酸素分子の数は何個か。 28÷22.4=1.25 1.25mol= 6.02×10²³×1.25= 7.525×10²³個 |
練習2)物質量と物質の量について、以下の問いに答えよ。原子量は以下の値を用いる。
H=1 C=12 N=14 O=16 Na=23 Al=27 S=32 Cl=35.5 Ca=40
(1) 二酸化炭素分子1個に含まれる炭素原子と酸素原子はそれぞれ何個か?
二酸化炭素分子はCO2。
炭素原子は1[mol]、酸素原子は2[mol]で構成されるので、
炭素原子は 1×6.0×1023個
酸素原子は 2×6.0×1023 = 12.0×1023[個]が正解
(2) アンモニア分子10個に含まれる窒素原子と水素原子はそれぞれ何個か
アンモニアの分子式は( )。
アンモニア窒素原子が1[mol]と水素原子3[mol]で構成されるね。
1[mol]は窒素原子が[ 」個で、水素原子[ 」個
アンモニア分子10個だから
窒素原子が10×[ ]個と水素原子が[ 」個になります。
(3) 水分子H2Oが 3.0×1023[個]のとき、水素原子と酸素原子はそれぞれ何[mol]か?
分子3.0×1023[個]は ( )[mol]。
水素原子は2×( )[mol]。酸素原子は1×( )[mol]になります。
(4) 二酸化炭素CO2の分子1個の質量は
二酸化炭素分子の質量は 12+16×2=44 44[g]
ここでは単に分子レベルで分子1個の質量は、そのまま( )[g]
(5) 塩化カルシウムCaCl2が33.3[g]について Ca=40 , Cl=35.5
| |
 |
塩化カルシウムも同じ考え方です。上はヒントです。考えてみましょう
① 物質量は何[mol]か。
1[mol]で40+71=111gなので 33.3[g]は( )[mol]
②Ca2+ とCl-はそれぞれ何[mol]か。
カルシウムイオンと塩化物イオンはイオン式から( )[mol]、( )[mol]。
③ Ca2+CとCl-はそれぞれ何[個]か。
カルシウムイオンは( )[mol]なので( )[g]。塩化物イオンは( )[g]
(6) アンモニアNH3が3.4[g]について (原子量 H=1 , N=14)
① 物質量は何[mol]か。
1[mol]の質量は( )[g]なので( )[mol]
② 標準状態で体積は何[L]か。
( )[mol]ということは、単に( )[L]だね。
③ アンモニア分子は何[個]か。
( )[mol]だから個数は( )[個]だよね。
(7) 窒素N2 1.5x1023[個]について
① 窒素分子の物質量は何[mol]か。
1[mol]は( )個。じゃあ1.5X1023[個]は