プラスの電荷をもったナトリウムイオンと、マイナスの電荷をもったクロール
イオン(塩化物イオン)という物質にわかれます。
物質はイオンになると、私たちの身体の細胞膜を簡単に通過することができる
ようになり、身体に吸収されやすくなります。NaCl → Na++Cl-
化学変化とイオン
戻る
2年生の復習
イオンを学習するまえに以下の化学式等、確認してください。
問 下の表に化学式を書き入れなさい。
|
|
化 学 式 |
|
化 学 式 |
|
酸素 |
|
亜 鉛 |
|
|
水素 |
|
塩化水素(塩酸) |
|
|
炭素 |
|
塩化ナトリウム |
|
|
二酸化炭素 |
|
酸化鉄 |
|
|
水 |
|
酸化銅 |
|
|
窒素 |
|
アンモニア |
|
|
塩素 |
|
水酸化ナトリウム |
|
|
銀 |
|
酸化マグネシウム |
|
|
鉄 |
|
酸化銀 |
|
以下、答え
|
|
化 学 式 |
|
化 学 式 |
|
酸素 |
O2 |
亜 鉛 |
Zn |
|
水素 |
H2 |
塩化水素(塩酸) |
HCl |
|
炭素 |
C |
塩化ナトリウム |
NaCl |
|
二酸化炭素 |
CO2 |
酸化鉄 |
FeO |
|
水 |
H2O |
酸化銅 |
CuO |
|
窒素 |
N2 |
アンモニア |
NH3 |
|
塩素 |
Cl2 |
水酸化ナトリウム |
NaOH |
|
銀 |
Ag |
酸化マグネシウム |
MgO |
|
鉄 |
Fe |
酸化銀 |
Ag2O |
以下に化学反応式の一部を例としてあげます。
水の電気分解:2H2O→ 2H2+O2
炭素の燃焼: C+O2 → C+O2
マグネシウムの燃焼 2Mg+O2→2MgO
硫黄の燃焼 S+O2 →SO2
酸化銀の熱分解 2Ag2O
→ 4Ag+O2
塩化水素(塩酸)と水酸化ナトリウムの反応[中和]: HCl+NaOH → NaCl+H2O
塩化ナトリウムの分解: 2NaCl →2Na+Cl2
|
問 左辺と右辺が合うように、□の中に数字を入れなさい。 ②炭素の燃焼: □C+□O2 → □C+□O2 ⑥塩化水素(塩酸)と水酸化ナトリウムの反応:□HCl+□NaOH →□NaCl+□H2O ⑦塩化ナトリウムの分解: □NaCl →□Na+□Cl2 |
| ・フェノールフタレイン溶液・・・アルカリ性かどうかを調べるときに使われる 酸性・中性・・・白色(酸性と中性は区別できない) アルカリ性・・・赤色(アルカリ性が強いほど色が濃くなる) ・ベネジクト液・・・糖の検出で調べる(中学校では主にだ液の働きを調べる実験で使われる) もとは青色(アルカリ性) 加熱して糖があると、赤褐色の沈殿(酸化銅の沈殿)が見られる。「加熱する」という操作が必要です。 ・ヨウ素液・・・デンプンの検出に使われる デンプンがあると少量でも反応し、青紫色に染まる。ジャガイモで実験したことあると思うよ。 ・BTB溶液・・・物質が酸性、中性、アルカリ性のどれなのかを調べる 酸性・・・黄色 中性・・・緑色 アルカリ性・・・青色 ・石灰水・・・二酸化炭素があると白くにごる ★塩酸・・・酸性で化学式はHCl ・鉄、マグニシウム、亜鉛などの金属を入れると水素が発生する ・硫化鉄を入れると硫化水素(卵が腐ったようなにおいがする)が発生する ・石灰石を入れると二酸化炭素が発生する ・水酸化ナトリウム水溶液と交ぜて中性にすると食塩水になる ★水酸化ナトリウム水溶液・・・アルカリ性で化学式はNaOH 中学校では主に塩酸との中和の実験や水の電気分解で使われる液体 ・塩酸と交ぜて中性にすると食塩水になる ・水の電気分解のとき、水だけではほとんど電流が流れないため水酸化ナトリウムを交ぜて行われる ・アンモニア水・・・アルカリ性で鼻を刺すようなにおいがする ・塩素 |
| 問 以下は試験薬、または検査用に用いる物質です。 ・( )…アルカリ性かどうかを調べるときに使われる 酸性・中性・・・白色(酸性と中性は区別できない) アルカリ性・・・赤色(アルカリ性が強いほど色が濃くなる) ・( )…糖の検出で調べる(だ液の働きを調べる実験で使われる) もとは青色(アルカリ性) 加熱して糖があると、赤褐色の沈殿(酸化銅の沈殿)が見られる。「加熱する」という操作が必要です。 ・( )…デンプンの検出に使われる デンプンがあると少量でも反応し、青紫色に染まる。 ・( )溶液…物質が酸性、中性、アルカリ性のどれなのかを調べる 酸性・・・黄色 中性・・・緑色 アルカリ性・・・青色 ・( )…二酸化炭素があると白くにごる |
| 問 ( )内に適切な言葉を書いてください。
①水酸化ナトリウムの化学式は( )でアルカリ性。リトマス試験紙は( )色から( )色に変化します。また、フェノールフタレインは無色透明から( )色に変化します。 ② 石灰水は炭酸ガスと反応し( )濁ります。 |
[メモ] 実験中は窓を開け、密閉を避けますが、発生する気体など物質には危険なものが多いのです。
下に二酸化炭素と一酸化炭素の危険度を表にしています。
|
空気中における二酸化炭素濃度(%) |
吸引時間と中毒症状 現在の空気中濃度 0.04% |
|---|---|
|
3-6% |
数分から数十分の吸入で、過呼吸、頭痛、めまい、悪心、知覚の低下 |
|
10%以上 |
数分以内に意識喪失し、放置すれば急速に呼吸停止を経て死に至る |
|
30%以上 |
ほとんど8-12呼吸で意識を喪失する |
COによる中毒危害
|
空気中における一酸化炭素濃度(%) |
吸引時間と中毒症状 |
|---|---|
|
0.04 |
1~2時間で前頭痛や吐き気、2.5~3.5時間で後頭痛 |
|
0.16 |
20分間で頭痛・めまい・吐き気がして、2時間で死亡 |
|
0.32 |
5~10分で頭痛・めまい、30分間で死亡 |
|
0.64 |
1~2分で頭痛・めまい、15~30分間で死亡 |
|
1.28 |
1~3分間で死亡 |
1章 水溶液とイオン
イオンとは、水に溶けると電気を通す物質(電解質)が水に溶けて(電離して)、
プラスやマイナスに電気を帯びた状態のことです。
たとえばスポーツドリンクにはナトリウムイオン、塩化物イオン(クロールイオン)、
カルシウムイオン、カリウムイオン、マグネシウムイオン等のイオンが入っています。
点滴とほぼ同じ成分と言っていいでしょう。
| 【参考】 食塩(塩化ナトリウム:電解質)は水に溶けると、 プラスの電荷をもったナトリウムイオンと、マイナスの電荷をもったクロール イオン(塩化物イオン)という物質にわかれます。 物質はイオンになると、私たちの身体の細胞膜を簡単に通過することができる ようになり、身体に吸収されやすくなります。NaCl → Na++Cl- |
| 分類 | 性質・例 |
| 水溶液が電流を流す物質 例 塩化水素(塩酸)、水酸化ナトリウム など |
|
| 水溶液が電流を流さない物質 例 ショ糖、砂糖、ブドウ糖、エタノール など |
陽イオンと陰イオン
物質は分子、または原子が集まってできています。
この粒子(分子、原子)の集まり方(状態)が変化して気体、液体、固体となるのが状態変化です。
状態変化では物質そのものは変化しない。
物質をつくっている原子の組み合わせが変化するのが化学変化である。
化学変化では全く異なる物質に変化する。
陽イオン
価電子の少ない原子は、電子を失って陽イオンになります。
陰イオン
価電子の多い原子は、電子を受け取って陰イオンになります。
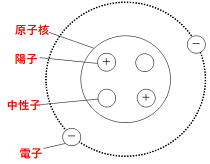
原子の構造 (原子は物質を構成する最小の粒子で、
すべての物質は原子が集まってできているといえます)
|
・電子・・・・・-の電気を帯びた粒。 ・原子核・・・・陽子(+の電気を帯びた粒)と 中性子(+でも-でもない粒)からなる。 ・陽子と電子の数は等しい。これを「電気的に中性」という。 ・物質はすべて原子という粒子が集まってできている。 ・原子は種類によって固有の大きさ、質量をもつ。 ・化学変化の前後で、原子はなくなったり、新しくできたり、 別の種類のものに変わることはない。 原子が集まってはじめて性質を持ち、その集まりを分子と呼びます。 ※なかには原子単独で性質を示すものもあります。 |
 |
H2Oは本当は「H2O1」ということでO1の1は省略します。
・H原子(水素原子)が2個
・O原子(酸素原子)が1個集まってできているということです。
2章 化学変化と電池
◇陽イオンになりやすい金属の並び順
K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au

上図の矢印の左にあるほどイオンになりやすく、「イオン化傾向」と呼ばれます。
なお、中学生の場合、上の図の7つ覚えるだけで良いでしょう。
■化学電池の原理
|
(1)塩酸(電流を通す水溶液)に2種類の金属 (ここでは亜鉛と銅) が入っています。 |
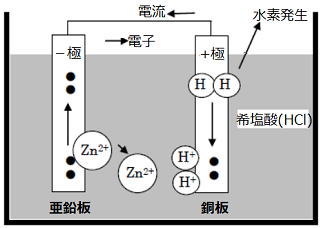 化学電池は電流を通す水溶液(電解質)を使う必要があります。蒸留水には電流は非常に流れにくいので、電池として電流はとり出せません。 |
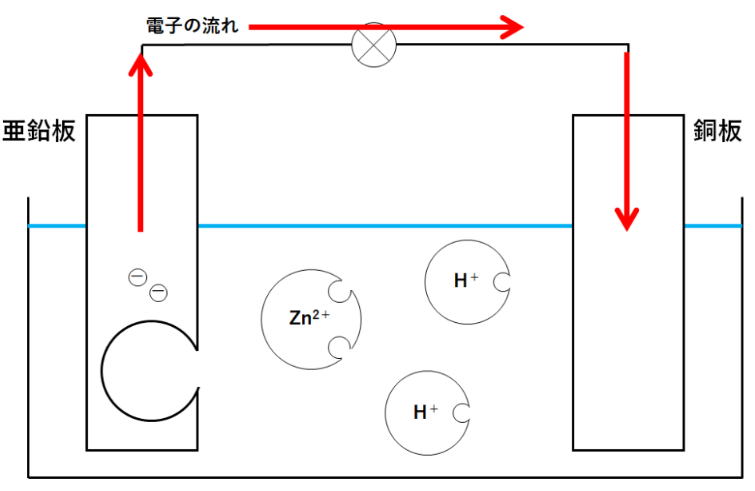
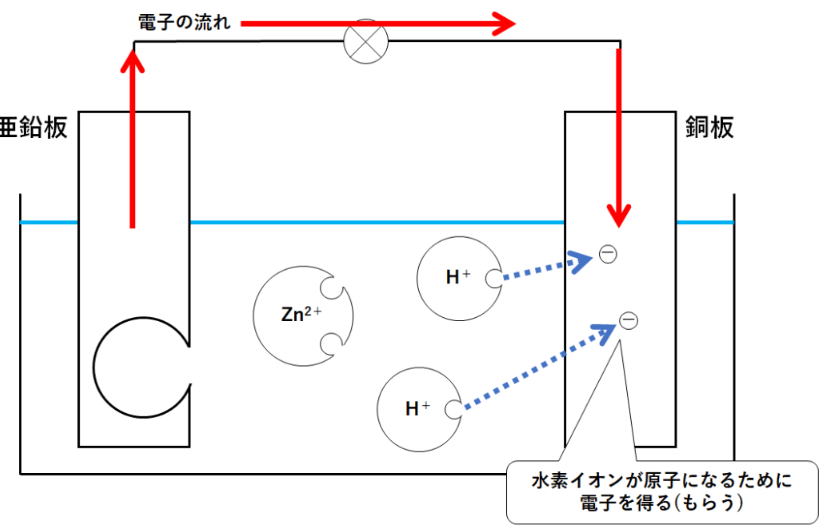
| 問 図のような装置を使い、うすい塩酸(希塩酸)に銅板と亜鉛板をいれたところ、光電池用モーターが回転した。次の問いに答えなさい。 ① モーターが回っているとき、銅板ではどのような変化が起きていますか ② ①の化学変化を電子をΘとして式で表しなさい。 ③ 亜鉛板は実験後、どのような状態になっていますか ④ ③の化学変化を電子を Θとして式で表しなさい。 ⑤ この実験で+極は銅板と亜鉛板のどちらか。 ⑥ この実験のように化学エネルギーを電気エネルギーに変えるしくみをなんというか ⑦ 装置を次のように変更した場合、電球はどうなりますか A: 薄い塩酸を砂糖水に変えた。 B: 亜鉛板と銅板を入れ替えた。 C: 亜鉛板を銅板にかえた。 |
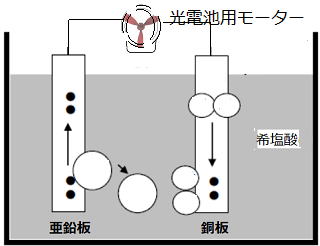 |
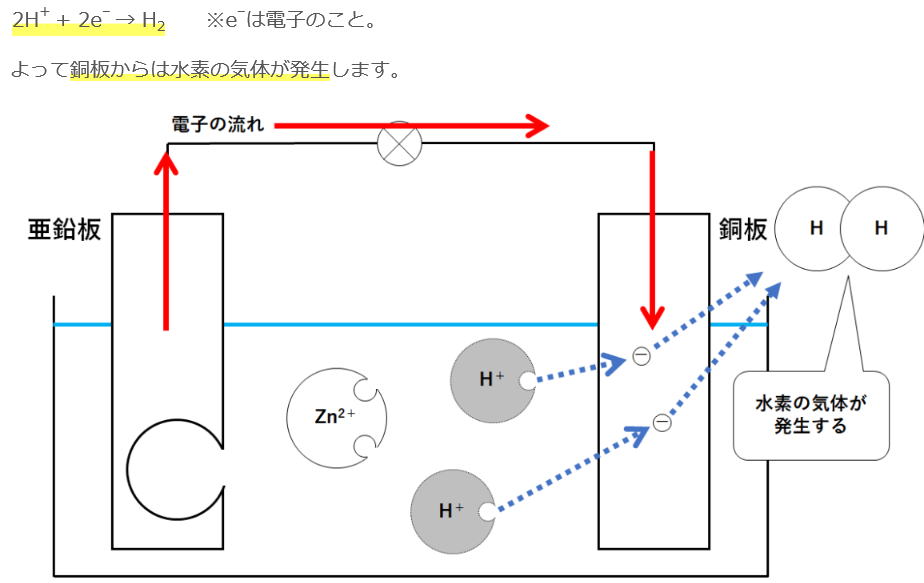
① モーターが回っているとき、銅板ではどのような変化が起きていますか。
答)気体が発生している。気体は水素ですね。
② ①の化学変化を電子をΘとして式で表しなさい。
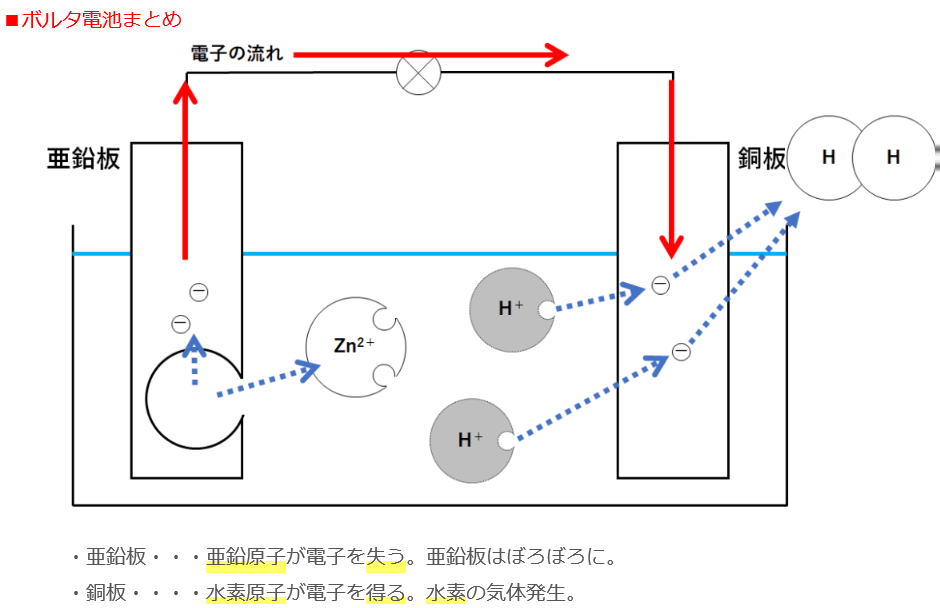
2H+ + ΘΘ→ H2
③ 亜鉛板は実験後、どのような状態になっていますか
表面が劣化してざらざらになった。
④ ③の化学変化を電子を Θとして式で表しなさい。
Zn → Zn2+ + ΘΘ
⑤ この実験で+極は銅板と亜鉛板のどちらか。
銅板 亜鉛板は電子を放出するので-極ですね。
⑥ この実験のように化学エネルギーを電気エネルギーに変えるしくみをなんというか
化学電池
⑦ 装置を次のように変更した場合、電球はどうなりますか
A: 薄い塩酸を砂糖水に変えた…回らない
B: 亜鉛板と銅板を入れ替えた…反対向きに回る
C: 亜鉛板を銅板にかえた………回らない
エネルギー
天然ガスやプロパンガスを燃やして(酸化させて)出た熱エネルギーでお湯を沸かします。
携帯用かいろは、中に入っている鉄粉が酸化することによって熱エネルギーを出します。
太陽電池は光エネルギーを直接電気エネルギーに変換しています。
水の力学的エネルギーを利用して水車を回し、発電させます。
化学電池の原理は電流の流れる水溶液に2種類の金属を入れることで電流をとり出します。 10円玉(銅)と1円玉(アルミニウム)が食塩水(電流を通す水溶液)に接することによって電流をとり出せます。
火力発電は化石燃料を燃やして得た熱エネルギーで水を沸かして、蒸気で発電機のタービンを回して発電します。
3章 酸・アルカリとイオン