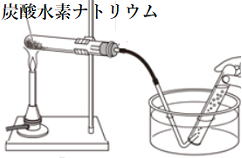
(反応式) 炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素
中2 単元1 化学変化と原子・分子
目次
| 1章 物質の成り立ち 1.熱分解 2.水の電気分解 3.物質をつくっているもの |
3章 化学変化と物質の質量 1.質量保存の法則 2.化合する物質の質量の割合 |
| 2章 いろいろな化学変化 1.物質が結びつく化学変化ー化合 2.化学反応式 3.酸素と結びつく化学変化ー酸化 4.酸素をうばう化学変化ー還元 |
4章 化学変化と熱の出入り 1.熱を発生する化学変化 2.熱を吸収する化学変化 |
物質の分解
1 熱分解
・炭酸水素ナトリウムの熱分解

(反応式) 炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素
・二酸化炭素は石灰水を白く濁らせる。
・水は塩化コバルト紙を青色から赤色に変化させる。
ホットケーキがスポンジ状にふくらむのは、ぺーキングパウダーに含まれる
炭酸水素ナトリウムが熱分解によってできた二酸化炭素二酸化炭素が生地を
2 水の電気分解
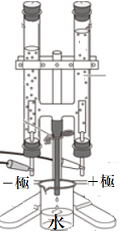
(反応式) 水→酸素+水素 化学式は?
2H2O→ 2H2+O2
![]() 左辺と右辺で原子の数が合わない。
左辺と右辺で原子の数が合わない。
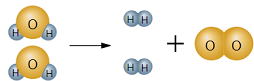 原子の数が合ったね。
原子の数が合ったね。
水素の燃焼(爆発)
H2 + O2 → H2O
水素 酸素 水 水素と酸素の原子の数を合わせよう。
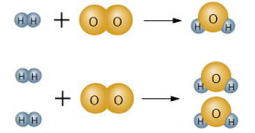 これで左辺と右辺、原子の数が合ったね。
これで左辺と右辺、原子の数が合ったね。
酸化・還元
■酸化 物質が酸素と化合すること。
例 C+O2→CO2
2H2+O2→2H2O
酸化物…… 酸素が化合してできた物質
燃焼 …… 熱や光をともなうはげしい酸化。
■還元 酸素の化合物から酸素を奪うこと。または、ある物質が水素と化合すること。
金属の燃焼
(例)銅の酸化
 新品の10円玉
新品の10円玉  酸化した10円玉
酸化した10円玉
※10円玉は、銅が95%、残りの5%は亜鉛とスズからできています。
10円玉は長い年月をかけ酸化しますが、ここではマグネシウムや酸化銀を使った実験で熱を加えて酸化させます。
(反応の様子) 銅 + 酸素 → 酸化銅
2Cu+O2 → 2CuO
銅 (赤色または赤褐色)の粉末をステンレス皿に入れて加熱すると、
やがて黒ずんでいき酸化銅(黒色)が生じます。
これは空気中の酸素が銅と結びついた(酸化した)ためです。
〇マグネシウムの燃焼(酸化)
(反応の様子) マグネシウム + 酸素 → 酸化マグネシウム
2Mg+ O2 → 2MgO
マグネシウムの金属をガスバーナーで加熱すると明るい光を出しながら酸化していきます。
このように熱や光をともなう酸化を燃焼といいます。
※銅の場合は熱や光をともなわないので「燃焼」とは呼びません。
・酸化物の多くは黒っぽい色ですが、酸化マグネシウムは白色です。(注意)
・酸化銀の熱分解
以下の問題は入試にもよく出題されるので、重複した問いもありますので、悪しからず。
| 問 図は酸化銀を加熱する実験です。以下の問いに答えなさい。 (1) 酸化銀の色は何色 (2) 単体の金属に共通の性質で間違っているものはどれか。 1) 熱を伝えやすい 2) 磁石につく 3) 金属光沢がある 4) たたくとのびる (3) 電気を通しやすいのは酸化銀か、銀のどちらか (4) 酸化銀の化学式を書きなさい (5)発生した気体は (6) 酸化銀は白い物質に変わった。この白い物質は (7) この実験で酸化銀は( )と( )に分かれた。 このように1種類の物質が2種類以上の物質に分かれる 化学変化を( 漢字2字 )という。 また、加熱したときにおこる分解を(漢字3字)という。 (8) (7)の問いの化学変化を化学反応式で書きなさい。 (9) この実験で、酸化銀は(酸化/還元)して銀に変化した。 酸化/還元のどちらか。 |
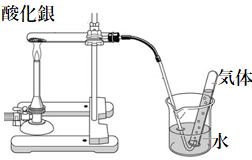 |
解説
(1) 酸化銀の色は黒
(2) 単体の金属に共通の性質で間違っているものはどれか。
1) 熱を伝えやすい 2) 磁石につく
3) 金属光沢がある 4) たたくとのびる 2)の「磁石につく」が正解
単体の金属は、熱を伝えやすく、電気を通しやすく、延性、展性があり、金属光沢がある。
磁石につくのは鉄など一部の金属だけです。
(3) 電気を通しやすいのは金属の銀
(4) 酸化銀の化学式は Ag2O
(5)発生した気体は酸素
(6) 酸化銀は白い物質に変わった。この白い物質は銀
(7) この実験で酸化銀は( 銀 )と( 酸素 )に分かれた。
このように1種類の物質が2種類以上の物質に分かれる化学変化を(分解)という。
また、加熱したときにおこる分解を(熱分解)という。
他に水などの電気分解があったね。
(8) (7)の問いの化学変化を化学反応式で書きなさい。
2Ag2O →4Ag+O2
(9) 酸化銀を加熱する実験で、酸化銀は(酸化/還元)して銀に変化した。
還元が正解

(反応式) 酸化銀→銀+酸素 化学式は?
| 例 スチールウール(鉄)を空気中で加熱したら、別の物質に変化した。この化学変化について、次の問いに答えなさい。 (1) 加熱前のスチールウールの質量と過熱後の物質の質量を比べると、どちらが大きいか。また、それはなぜか? (2) 過熱によって得られた物質はなにか?物質名を答えよ。 (3) 加熱前のスチールウールと、過熱後の物質を塩酸の入った試験管にそれぞれ入れた。気体が多く発生したのは、どちらを入れたほうか。また、この気体は何か。 |
(1) 過熱後。 酸素と結びついたため (2) 酸化鉄
(3) 加熱後のスチールウール。 水素 2Fe+2HCl →2FeCl+H2
| 問 マグネシウムを空気中で加熱したら、光と熱を発して化学変化した。次の問いに答えなさい。 (1) マグネシウムの質量と過熱後の物質の質量はどちらが大きいか。また、それはなぜか? (2) 過熱によって得られた物質はなにか? (3) この化学変化を化学反応式で表しなさい。 |
(1) 過熱後の方が質量が大きくなる。酸素と結びついたため。
(2) 酸化マグネシウム
(3) 2Mg + O2 → 2MgO
酸化銅の燃焼
| 問 右の図のような装置で、酸化銅と炭(炭素)の混合物を加熱した。次の問いに答えなさい。
(1) 石灰水が入った試験管はどのように変化するか。 |
酸化銅と炭素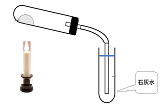 |
(1) 白く濁る (2) 黒色から赤(茶)色に変化する。(3) 炭
(4) 酸化銅 (5) 2CuO + C → 2Cu + CO2
(6) 炭素が酸化銅から酸素原子をうばい、二酸化炭素に変化している。
このとき,酸化銅は(還元)されるが,炭素は逆に(酸化)されています。
問 下の図に化学式を書きなさい。
|
|
化 学 式 |
|
化 学 式 |
|
酸素 |
|
亜 鉛 |
|
|
水素 |
|
塩化水素(塩酸) |
|
|
炭素 |
|
塩化ナトリウム |
|
|
二酸化炭素 |
|
酸化鉄 |
|
|
水 |
|
酸化銅 |
|
|
窒素 |
|
アンモニア |
|
|
塩素 |
|
水酸化ナトリウム |
|
|
銀 |
|
酸化マグネシウム |
|
|
鉄 |
|
酸化銀 |
|
以下、答え
|
|
化 学 式 |
|
化 学 式 |
|
酸素 |
O2 |
亜 鉛 |
Zn |
|
水素 |
H2 |
塩化水素(塩酸) |
HCl |
|
炭素 |
C |
塩化ナトリウム |
NaCl |
|
二酸化炭素 |
CO2 |
酸化鉄 |
FeO |
|
水 |
H2O |
酸化銅 |
CuO |
|
窒素 |
N2 |
アンモニア |
NH3 |
|
塩素 |
Cl2 |
水酸化ナトリウム |
NaOH |
|
銀 |
Ag |
酸化マグネシウム |
MgO |
|
鉄 |
Fe |
酸化銀 |
Ag2O |
化学反応式の一部例) 水の電気分解:2H2O→
2H2+O2
炭素の燃焼: C+O2 → CO2 マグネシウムの燃焼 2Mg+O2 →2MgO
硫黄の燃焼 S+O2 →SO2 酸化銀の熱分解 2Ag2O → 4Ag+O2
塩化水素(塩酸)と水酸化ナトリウムの反応[中和]: HCl+NaOH → NaCl+H2O
塩化ナトリウムの分解: 2NaCl →2Na+Cl2
| ・フェノールフタレイン溶液・・・アルカリ性かどうかを調べるときに使われる 酸性・中性・・・白色(酸性と中性は区別できない) アルカリ性・・・赤色(アルカリ性が強いほど色が濃くなる) ・ベネジクト液・・・糖の検出で調べる(中学校では主にだ液の働きを調べる実験で使われる) もとは青色(アルカリ性) 加熱して糖があると、赤褐色の沈殿(酸化銅の沈殿)が見られる。「加熱する」という操作が必要です。 ・ヨウ素液・・・デンプンの検出に使われる デンプンがあると少量でも反応し、青紫色に染まる。ジャガイモで実験したことあると思うよ。 ・BTB溶液・・・物質が酸性、中性、アルカリ性のどれなのかを調べる 酸性・・・黄色 中性・・・緑色 アルカリ性・・・青色 ・石灰水・・・二酸化炭素があると白くにごる ★塩酸・・・酸性で化学式はHCl ・鉄、マグニシウム、亜鉛などの金属を入れると水素が発生する ・硫化鉄を入れると硫化水素(卵が腐ったようなにおいがする)が発生する ・石灰石を入れると二酸化炭素が発生する ・水酸化ナトリウム水溶液と交ぜて中性にすると食塩水になる ・水酸化ナトリウム水溶液・・・アルカリ性で化学式はNaOH 中学校では主に塩酸との中和の実験や水の電気分解で使われる液体 ・塩酸と交ぜて中性にすると食塩水になる ・水の電気分解のとき、水だけではほとんど電流が流れないため水酸化ナトリウムを交ぜて行われる ・アンモニア水・・・アルカリ性で鼻を刺すようなにおいがする |
単元2
単元3
単元4
質量・保存の法則
反応の前後で質量の総和は変化しない。
→ 化学変化では原子の組み合わせは変わるが、原子の数や種類は変化しないため。
化学式 以下の化学式はしっかり覚えよう‼
| 水素 H2 酸素 O2 水 H2O |
| 窒素 N2 アンモニア NH3 |
| 銅 Cu 銀 Ag |
| 炭素 C 塩素Cl2 塩酸(塩化水素) HCl |
| 酸化銅 CuO |
| 硫化鉄 FeS |
| 炭酸ナトリウム Na2CO3 |
| 水酸化ナトリウム NaOH |
| 物質名 | 化学式 | 物質名 | 化学式 |
| 水 | H2O | 酸化銅 | CuO |
| アンモニア | NH3 | 酸化マグネシウム | MgO |
| 二酸化炭素 | CO2 | 酸化銀 | Ag2O |
| 炭酸水素ナトリウム | NaHCO3 | 水酸化ナトリウム | NaOH |
| 塩化水素 (塩酸) | NaCl | 塩化ナトリウム | NaCl |
試験薬 及び化学物質の特徴
・フェノールフタレイン溶液・・・アルカリ性かどうかを調べるときに使われる
酸性・中性・・・白色(酸性と中性は区別できない)
アルカリ性・・・赤色(アルカリ性が強いほど色が濃くなる)
・BTB溶液・・・物質が酸性、中性、アルカリ性のどれなのかを調べる
酸性・・・黄色 中性・・・緑色 アルカリ性・・・青色
・ベネジクト液・・・糖の検出で調べる(中学校では主にだ液の働きを調べる実験で使われる)
もとは青色(アルカリ性)
加熱して糖があると、赤褐色の沈殿(酸化銅の沈殿)が見られる。「加熱する」という操作が必要です。
・ヨウ素液・・・デンプンの検出に使われる
デンプンがあると少量でも反応し、青紫色に染まる。ジャガイモで実験したことあると思うよ。
・石灰水・・・二酸化炭素があると白くにごる
★塩酸・・・酸性で化学式はHCl
・鉄、マグニシウム、亜鉛などの金属を入れると水素が発生する
・硫化鉄を入れると硫化水素(卵が腐ったようなにおいがする)が発生する FeS + 2HCl → H2S + FeCl2
・石灰石を入れると二酸化炭素が発生する
・水酸化ナトリウム水溶液と交ぜて中性にすると食塩水になる NaOH + HCl → NaCl + H2O
★水酸化ナトリウム水溶液・・・アルカリ性で化学式はNaOH
・塩酸と交ぜて中性にすると食塩水になる
・水の電気分解のとき、水だけではほとんど電流が流れないため水酸化ナトリウムを交ぜて行われる
・アンモニア水・・・アルカリ性で鼻を刺すようなにおいがする
化学反応式 覚えなくて、反応前後の原子の数で、左辺 → 右辺で原子の数を合わせよう。
例えば、水素と酸素が化合して水ができる 2H2 + O2 → 2H2O を例にとってみよう。
①H20 → H2 + O2
H(水素や)O(酸素)は自然界に存在しません。
私たちに必要な酸素はO2として存在します。
左辺にO(酸素原子)は1個、右辺に2個。さあ、数合わせゲームです。
2H2O → H2 + O2
Oは合ったけど、左辺のH(水素原子)が4個に対し、
右辺のHは2個です。2H2 でHが4個。これでOK‼
2H20 → 2H2 + O2
② ( )NaOH + ( )HCl → ( )NaCl + ( )H2O
| この反応式も同じように左辺のH2に注目するとHは2個。NaOH、HClに1個ずつあります。 NaもClも1個ずつですので、 そのまま (1)NaOH + + ( 1)HCl → (1)NaCl + (1)H2O ですね。 |
| 水素と酸素が化合し、水ができる。 2H2 + O2 → 2H2O |
| 水を分解し、水素と酸素ができる。 2H2O → 2H2 + O2 |
| 炭素が燃焼し、二酸化炭素ができる。 C + O2 → CO2 |
| 酸化銀を分解し、銀と酸素ができる。 2Ag2O → 4Ag + O2 |
| 銅が酸化し、酸化銅ができる。 2Cu + O2 → 2CuO |
| マグネシウムが燃焼し、酸化マグネシウムができる。 2Mg + O2 → 2MgO |
| 炭酸水素ナトリウムを分解し、炭酸ナトリウム、水、二酸化炭素ができる。 2NaHCO3 → Na2CO3 + H2O + CO2 |
| 鉄と硫黄が化合する Fe + S → FeS |
| 鉄と銅が化合する Cu + S → CuS |
| 練習問題 1.( )内に数字を入れて化学反応式を完成させましょう。 ただし数字を入れる必要のないところは空らんにしなさい。 (1)水の電気分解 水→水素+酸素 ( )H2O → ( )H2 + ( )O2 (2) マグネシウムの酸化 マグネシウム+酸素→酸化マグネシウム ( )Mg + ( )O2 → ( )MgO (3) 炭酸水素ナトリウムの熱分解 炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素 ( )NaHCO3 → ( )Na2CO3 + ( )H2O +( )CO2 (4) 酸化銅を炭素で還元 酸化銅+炭素→銅+二酸化炭素 ( )CuO + ( ) C → ( )Cu + ( )CO2 (5) 酸化銀の熱分解 酸化銀→銀+酸素 ( )Ag2O → ( )Ag + ( )O2 (6) 亜鉛に塩酸をかける 亜鉛+塩酸→塩化亜鉛+水素 ( )Zn + ( )HCl → ( )ZnCl2 + ( )H2 2.カッコ内に適切な化学式を入れて化学反応式を完成させよ。(1) 塩化銅の電気分解 ( ) → Cu + ( ) (2) 酸化銅を水素で還元する CuO + → Cu + ( ) (3) 鉄と硫黄の化合 Fe + ( ) → ( ) (4) 炭素の酸化 ( ) + O2 → ( ) |
解答) (1) 2H2O → 2H2 + O2
水の電気分解 水→水素+酸素 (2) 2Mg + O2 → 2MgO
マグネシウムの酸化 マグネシウム+酸素→酸化マグネシウム
(3)2NaHCO3 → Na2CO3 + H2O +CO2
炭酸水素ナトリウムの熱分解 炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素
(4)2CuO + C → 2Cu + CO2
酸化銅を炭素で還元 酸化銅+炭素→銅+二酸化炭素
(5)2Ag2O → 4Ag + O2
酸化銀の熱分解 酸化銀→銀+酸素
(6) Zn + 2HCl → ZnCl2 + H2
亜鉛に塩酸をかける 亜鉛+塩酸→塩化亜鉛+水素
| 2.カッコ内に適切な化学式を入れて化学反応式を完成させよ。 (1) 塩化銅の電気分解 CuCl2 → Cu + Cl2 (2) 酸化銅を水素で還元する CuO + H2 → Cu +H2O (3) 鉄と硫黄の化合 Fe + S → FeS (4) 炭素の酸化 C + O2 → CO2 |